Reale Stoffe: Unterschied zwischen den Versionen
Admin (Diskussion | Beiträge) (Die Seite wurde neu angelegt: In der Vorlesung zu Entropie und Enthalpie haben wir uns ein erstes Mal mit dem thermischen Verhalten realer Stoffe beschäftigt. Damals ist es ums Kühlen und Heiz...) |
Admin (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| Zeile 5: | Zeile 5: | ||
==thermische Zustandsfläche== |
==thermische Zustandsfläche== |
||
[[Bild:ideales_Gas_ZF.gif|thumb|Zustandsfläche des idealen Gases]] Trägt man alle Gleichgewichtszustände des idealen Gases in ein Druck-Temperatur-Volumen-Schaubild ein, erhält man eine Zustandsfläche, welche bei ''T'' = 0 entlang der Druck- und Temperaturachse verläuft und sich für bei höher werdenden Temperaturen immer mehr von der Temperaturachse entfernt. Auf dieser Zustandsflächen können drei verschiedene Kurvenscharen eingezeichenet werden |
|||
*Isobaren: Schnitt mit Ebenen, die parallel zur Temperatur- und Volumenachse gelegt werden, die normal zur Druckachse stehen |
|||
*Isochoren: Schnitt mit Ebenen, die parallel zur Druck- und Temperaturachse gelegt werden, die normal zur Volumenachse stehen |
|||
*Isothermen: Schnitt mit Ebenen, die parallel zur Druck- und Volumenachse gelegt werden, die normal zur Temperaturachse stehen |
|||
Projiziert man die Zustandsfläche auf die ''p-V-''Ebene, stellen die Isothermen das Boylsche Gesetz dar. Eine Projektion auf die ''p-T-''Ebene liefert die Kurvenschar der Isochoren, welche das Gay-Lussac-Gesetz graphisch darstellen. Eine dritte Projektion auf die ''T-V-''Ebene zeigt die Isobaren. Von den vier möglichen Basisprozessen des idealen Gases verlaufen drei parallel zu einer der drei Koordinateneben. |
|||
Selbstverständlich kann man jede mögliche Zustandsänderung auf jede Koordinatenebene projizieren. Die Darstellung im ''p-V-''Diagramm nennt man auch Arbeitsdiagramm, weil die Fläche unter der Kurve für die vom Gas geleistete Arbeit steht. Im ''p-V-''Diagramm erscheinen die Isobaren als horizontale und die Isochoren als vertikale Linien. Die Isothermen bilden eine Schar von Hyperbeln. |
|||
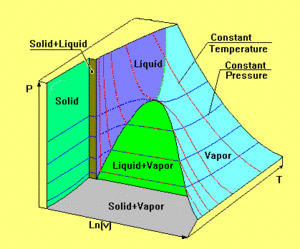
[[Bild:Zustandsflaeche2.gif|thumb|Zustandsfläche eines realen Stoffs]] |
|||
==Luftfeuchtigkeit== |
==Luftfeuchtigkeit== |
||
Version vom 5. Februar 2008, 07:13 Uhr
In der Vorlesung zu Entropie und Enthalpie haben wir uns ein erstes Mal mit dem thermischen Verhalten realer Stoffe beschäftigt. Damals ist es ums Kühlen und Heizen bei konstantem Druck gegangen. Diesmal wollen wir beide Potenzialgrössen (Temperatur und Druck) verändern und den realen Stoff mit dem Carnotor simulieren. Eine wichtige Anwendung ist der Rankine-Zyklus.
Lernziele
In dieser Vorlesung lernen Sie
thermische Zustandsfläche
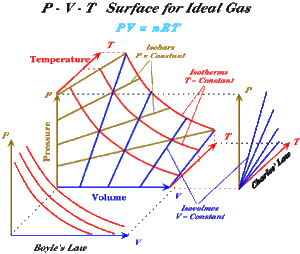
Trägt man alle Gleichgewichtszustände des idealen Gases in ein Druck-Temperatur-Volumen-Schaubild ein, erhält man eine Zustandsfläche, welche bei T = 0 entlang der Druck- und Temperaturachse verläuft und sich für bei höher werdenden Temperaturen immer mehr von der Temperaturachse entfernt. Auf dieser Zustandsflächen können drei verschiedene Kurvenscharen eingezeichenet werden
- Isobaren: Schnitt mit Ebenen, die parallel zur Temperatur- und Volumenachse gelegt werden, die normal zur Druckachse stehen
- Isochoren: Schnitt mit Ebenen, die parallel zur Druck- und Temperaturachse gelegt werden, die normal zur Volumenachse stehen
- Isothermen: Schnitt mit Ebenen, die parallel zur Druck- und Volumenachse gelegt werden, die normal zur Temperaturachse stehen
Projiziert man die Zustandsfläche auf die p-V-Ebene, stellen die Isothermen das Boylsche Gesetz dar. Eine Projektion auf die p-T-Ebene liefert die Kurvenschar der Isochoren, welche das Gay-Lussac-Gesetz graphisch darstellen. Eine dritte Projektion auf die T-V-Ebene zeigt die Isobaren. Von den vier möglichen Basisprozessen des idealen Gases verlaufen drei parallel zu einer der drei Koordinateneben.
Selbstverständlich kann man jede mögliche Zustandsänderung auf jede Koordinatenebene projizieren. Die Darstellung im p-V-Diagramm nennt man auch Arbeitsdiagramm, weil die Fläche unter der Kurve für die vom Gas geleistete Arbeit steht. Im p-V-Diagramm erscheinen die Isobaren als horizontale und die Isochoren als vertikale Linien. Die Isothermen bilden eine Schar von Hyperbeln.