Bohrsches Atommodell: Unterschied zwischen den Versionen
Admin (Diskussion | Beiträge) (Die Seite wurde neu angelegt: Das '''Bohrsche Atommodell''' wurde 1913 von ''Niels Bohr'' entwickelt und baut auf dem ''Rutherfordsches Atommodell'' (Elektronen umkreisen einen kleinen positiv gelad...) |
Admin (Diskussion | Beiträge) |
||
| (15 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Das '''Bohrsche Atommodell''' wurde 1913 von ''Niels Bohr'' entwickelt und baut auf dem ''Rutherfordsches Atommodell'' (Elektronen umkreisen einen kleinen positiv geladenen Atomkern) auf. Das Bohrsche Atommodell konnte wohl die Spektrallinien des Wasserstoffatoms erklären, erwies sich sonst aber als Sackgasse. Dass dieses Modell heute noch an Schulen gelehrt wird, ist ein deutliches Indiz für den Reformbedarf des Physikunterrichts. |
[[Bild:RutherfordAtommodell.jpg|thumb|Planetenmodell von Rutherford]]Das '''Bohrsche Atommodell''' wurde 1913 von ''Niels Bohr'' entwickelt und baut auf dem ''Rutherfordsches Atommodell'' (Elektronen umkreisen einen serh kleinen, positiv geladenen Atomkern) auf. Das Bohrsche Atommodell konnte wohl die Spektrallinien des Wasserstoffatoms erklären, erwies sich sonst aber als Sackgasse. Dass dieses Modell heute noch an Schulen gelehrt wird, ist ein deutliches Indiz für den Reformbedarf des Physikunterrichts. |
||
== Modell == |
== Modell == |
||
| Zeile 8: | Zeile 8: | ||
# Elektronen bewegen sich auf stabilen Kreisbahnen um den Atomkern ohne elektromagnetische Strahlung zu emittieren. |
# Elektronen bewegen sich auf stabilen Kreisbahnen um den Atomkern ohne elektromagnetische Strahlung zu emittieren. |
||
# Der Radius der Elektronenbahn ändert sich nicht kontinuierlich, sondern sprunghaft. Bei diesem [[Quantensprung]] wird ein [[Photon]] abgegeben oder aufgenommen. |
# Der Radius der Elektronenbahn ändert sich nicht kontinuierlich, sondern sprunghaft. Bei diesem [[Quantensprung]] wird ein [[Photon]] abgegeben oder aufgenommen. |
||
# Elektronenbahnen sind stabil, falls der [[Bahndrehimpuls]] des Elektrons ein ganzzahliges Vielfaches des ''' |
# Elektronenbahnen sind stabil, falls der [[Bahndrehimpuls]] des Elektrons ein ganzzahliges Vielfaches des '''Planckschen Wirkungsquantums''' <math>\hbar</math> ist. Dieses Postulat wird häufig auch ''Auswahlbedingung'' genannt. |
||
=== |
=== Bahnradius === |
||
Im Bohrschen Atommodell wird das Elektron (Masse ''m'', Ladung -''e'') durch die elektrostatische Kraft des Atomkerns auf einer Kreisbahn gehalten |
Im Bohrschen Atommodell wird das Elektron (Masse ''m'', Ladung -''e'') durch die elektrostatische Kraft des Atomkerns auf einer Kreisbahn gehalten ('''1.''' Postulat) |
||
:<math> F_E=\frac{1}{4\pi\ |
:<math> F_E=\frac{1}{4\pi\varepsilon_0}\frac{e^2}{r^2}=ma_n={mv^2\over r }</math> |
||
Der Bahndrehimpuls des Elektrons |
Der Bahndrehimpuls des Elektrons ''L'' ist nach dem '''3.''' Postulat quantisiert |
||
:<math>L=mvr=n\hbar \Leftrightarrow\ v={n\hbar\over mr}</math>. |
:<math>L=mvr=n\hbar \Leftrightarrow\ v={n\hbar\over mr}</math>. |
||
| Zeile 21: | Zeile 21: | ||
Setzt man die so gewonnene Beziehung zwischen Geschwindigkeit und Radius ins Grundgesetz der Mechanik ([[Impulsbilanz]]) ein, erhält man für den Radius ''r'': |
Setzt man die so gewonnene Beziehung zwischen Geschwindigkeit und Radius ins Grundgesetz der Mechanik ([[Impulsbilanz]]) ein, erhält man für den Radius ''r'': |
||
:<math> |
:<math>{1 \over 4\pi\varepsilon_0}{e^2 \over r^2 }={m({n\hbar\over mr})^2\over r} \Leftrightarrow {e^2 \over 4 \pi \varepsilon_0 r^2}={m n^2 \hbar^2 \over m^2r^3 } \Leftrightarrow</math> |
||
:<math> r=n^2{4 \pi\ |
:<math> r=n^2{4 \pi\varepsilon_0\hbar^2\over m e^2 }</math>. |
||
Der kleinste Radius wird als ''Bohrscher Atomradius'' bezeichnet |
Der kleinste Radius wird als ''Bohrscher Atomradius'' bezeichnet |
||
:<math> r_0 = { 4 \pi \ |
:<math> r_0 = { 4 \pi \varepsilon_0 \hbar^2 \over m e^2 } \approx 5.29 \cdot 10^{-11}m</math>. |
||
=== Energie === |
|||
=== Position der Linien im Spektrum des Wasserstoffs === |
|||
[[Bild:BohrschesAtommodellSerien.jpg|thumb|Bohrsches Atommodell]] Die potentielle Energie des Elektrons im Feld des Protons ist gleich |
|||
Im Coulombfeld des Kerns gilt für die potentielle Energie des Elektrons |
|||
:<math> |
:<math>W_E=-{1\over 4\pi\varepsilon_0}{e^2\over r}</math> |
||
=_{(3)} -{ e^2 \over 4 \pi \epsilon_0 (n^2{ 4 \pi \epsilon_0 \hbar^2 \over me^2 })} |
|||
| ⚫ | |||
= -{ e^2 m e^2 \over 16 \pi^2 \epsilon_0^2 n^2({h \over 2\pi})^2} |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
Demnach ist die Gesamtenergie des Elektrons im Feld des Protons gleich |
|||
| ⚫ | |||
= { e^2 \over 8 \pi \epsilon_0 r } |
|||
=_{(3)} { e^2 \over 8 \pi \epsilon_0 (n^2{ 4 \pi \epsilon_0 \hbar^2 \over me^2 }) } |
|||
= -{1 \over 2}E_{pot}</math>, |
|||
| ⚫ | |||
also für die Energie im <math>n</math>-ten Zustand |
|||
Setzt man nun die durch die Quantisierung des Bahndrehimpulses erlaubten Radien ein, erhält man die möglichen Energieniveaus |
|||
| ⚫ | |||
:<math>W={1\over 2}W_{pot}=-{1\over 8\pi\varepsilon_0}{e^2\over {n^2{4 \pi\varepsilon_0\hbar^2\over m e^2 }}}=-{m e^4\over 32\pi^2\varepsilon_0^2\hbar^2}{ 1\over n^2}</math>. |
|||
Für eine beliebige Kernladung mit Z Protonen ergibt sich eine Energie von |
|||
:<math> E_n = -{ m e^4 \over 8 \epsilon_0^2 h^2 } {Z^2 \over n^2} = -{ e^2 \over 8 \pi \epsilon_0 } {1\over a_0} {Z^2 \over n^2} = -13.6 {Z^2 \over n^2}{eV}</math>. |
|||
Die Energiedifferenz beim Übergang vom <math>n_1</math>-ten in den <math>n_2</math>-ten Zustand ist damit gleich |
|||
:<math>\Delta |
:<math>\Delta W = W_{n_2}-W_{n_1}={m e^4\over 32\pi^2 \varepsilon_0^2 \hbar^2}\left( {1 \over n_1^2 }-{1 \over n_2^2}\right)={m e^4\over 8 \varepsilon_0^2 h^2}\left( {1 \over n_1^2 }-{1 \over n_2^2}\right)</math> |
||
Bei der letzten Umformung ist das Drehimpulsquantum <math>\hbar</math> durch das um 2π grössere Wirkungsquantum ''h'' ersetzt worden. Diese Formel wurde bereits 1888 von ''Johannes Rydberg'' ohne Kenntnis eines Atommodells allein aufgrund von beobachteten Linienspektren aufgestellt. |
|||
Für das vom Elektron beim Übergang absorbierte oder emittierte [[Photon]] gilt der von ''Albert Einstein'' postulierte Zusammenhang zwischen Energie und Frequenz ''f'' |
|||
Für die Erklärung der Spektren ist man an der Frequenz interessiert, für die nach Planck gilt <math>E=h\nu</math>. Die Frequenz der emittierten Strahlung beim Sprung vom <math>n_1</math>-ten in den <math>n_2</math>-ten Zustand (<math>n_1 > n_2</math>) beträgt also |
|||
:<math>W=hf</math>. |
|||
:<math> \nu = { {m e^4} \over {8 \epsilon_0^2 h^3} } \left( {1 \over n_2^2} - {1 \over n_1^2} \right) </math>. |
|||
Springt das Elektron vom <math>n_1</math>-ten in den <math>n_2</math>-ten Zustand, ist die Frequenz des emittierten oder absorbierten Photons gleich |
|||
Diese Voraussage entspricht bis auf die vierte Dezimale den beobachteten Werten. |
|||
| ⚫ | |||
Exaktere Werte erhält man, wenn man bedenkt, dass der Kern sich beim Kreisen des Elektrons minimal mitbewegt - beide bewegen sich um den gemeinsamen Schwerpunkt, der aber innerhalb des in der Ruhemasse 1836 Mal schwereren Protons liegt - die [[Mechanik]] liefert einen Faktor |
|||
| ⚫ | |||
Lässt man <math>n_1</math> gegen Unendlich gehen, erhält man die Energie, die nötig ist, um ein Elektron aus dem Unendlichen bis zum Zustand <math>n_2</math> zu bewegen, also die Gesamtenergie des |
Lässt man <math>n_1</math> gegen Unendlich gehen, erhält man die Energie, die nötig ist, um ein Elektron aus dem Unendlichen bis zum Zustand <math>n_2</math> zu bewegen, also die Gesamtenergie des Zustands <math>n_2</math>. |
||
Exaktere Werte erhält man, wenn man berücksichtigt, dass sich sowohl das 1836 Mal schwerere Protons als auch das Elektrons um den gemeinsamen [[Massenmittelpunkt]] bewegen. Um den Einfluss des sich bewegenden Protons zu korrigieren, sind die Energie- und Frequenzwerte mit folgendem Faktor zu korrigieren |
|||
| ⚫ | |||
== Bestätigungen == |
== Bestätigungen == |
||
| Zeile 72: | Zeile 70: | ||
Das bohrsche Atommodell konnte eine Reihe von physikalischen Messergebnissen der im Entstehen begriffenen [[Atomphysik]] erklären. In nachfolgenden mit höherer Genauigkeit durchgeführten Experimenten zeigten sich allerdings auch deutliche Abweichungen zwischen Modell und Wirklichkeit. |
Das bohrsche Atommodell konnte eine Reihe von physikalischen Messergebnissen der im Entstehen begriffenen [[Atomphysik]] erklären. In nachfolgenden mit höherer Genauigkeit durchgeführten Experimenten zeigten sich allerdings auch deutliche Abweichungen zwischen Modell und Wirklichkeit. |
||
=== |
=== Grösse der Atome === |
||
Der mit den wenigen Grundannahmen des Modells berechnete Durchmesser von Atomen liegt für viele Elemente in der richtigen |
Der mit den wenigen Grundannahmen des Modells berechnete Durchmesser von Atomen liegt für viele Elemente in der richtigen Grössenordnung. Insbesondere stimmten sie grob mit den zur gleichen Zeit von ''Max von Laue'' und ''William Henry Bragg'' erstmals durchgeführten Experimenten zur Röntgenbeugung überein. Die kleine, aber endliche Grösse war eine Schlüssel-Eigenschaft der Atome in den noch vagen Vorstellungen zum Aufbau der Materie. Daher wurde die Fähigkeit des Bohr-Modells, die Grösse aus allgemeinen Annahmen abzuleiten, als Erfolg angesehen. |
||
=== Spektrale Übergänge === |
=== Spektrale Übergänge === |
||
Schon 1885 wurden spektrale Linien beim Wasserstoff-Atom entdeckt ( |
Schon 1885 wurden spektrale Linien beim Wasserstoff-Atom entdeckt (''Balmer-Serie'', später ''Lyman-Serie'', ''Paschen-Serie'' und weitere). Für die Position der Linien innerhalb der jeweiligen Serie konnte ''Johannes Rydberg'' anhand von gemessenen [[Linienspektrum|Linienspektren]] bereits 1888 eine numerische Formel angeben. Der physikalische Hintergrund dieser Formel blieb jedoch zwanzig Jahre lang ein Rätsel. Die von Bohr eingeführten spektralen Übergänge der Elektronen von einer Schale auf die andere erlaubten, die ''Rydberg-Formel'' aus allgemeinen Prinzipien abzuleiten. |
||
=== Franck-Hertz-Versuch === |
=== Franck-Hertz-Versuch === |
||
Eine weitere Bestätigung des |
Eine weitere Bestätigung des Bohrschen Atommodells erfolgte 1913/1914 mit dem [[Franck-Hertz-Versuch]]. In dem Versuch konnte gezeigt werden, dass die Abgabe von Energie nur in bestimmten, diskreten Paketen möglich ist. Damit war der Quantenaspekt des Bohrschen Atommodells bestätigt. |
||
| ⚫ | |||
| ⚫ | Das Atommodell von Bohr steht in vielen Punkten im Widerspruch zu der durch Messung zugänglichen Realität. Einige dieser Widersprüche waren bereits zur Zeit der |
||
* Die Postulate werden durch kein grundlegendes Prinzip, sondern allein durch ihren Erfolg gerechtfertigt. Sie widersprechen der klassischen [[Elektrodynamik]]. |
|||
* Chemische Bindungen können mit dem Bohr-Modell nicht verstanden werden. |
|||
| ⚫ | |||
* Sobald ein Atom mehr als ein Elektron besitzt, passen die mit dem Bohr-Modell berechneten Linienpositionen nicht zu den gemessenen Spektren. |
|||
| ⚫ | |||
* Bestimmte Spektrallinien des Wasserstoffs erweisen sich bei genaueren Messungen als Doppellinien. Diese nach ihrem Entdecker [[Lamb-Shift]] genannte Trennung kann das Bohr-Modell nicht erklären. |
|||
* Die in der [[Radioastronomie]] wichtige 21cm-Linie des Wasserstoffs kann nicht aus dem Bohr-Modell abgeleitet werden. |
|||
| ⚫ | |||
Die Theorie der [[Quantenmechanik]], deren Berechnungen bis heute in allen Details mit den experimentellen Befunden übereinstimmt, zeichnet mit dem [[Orbitalmodell]] ein grundsätzlich anderes Bild vom Atom. Ohne äußere Einwirkungen ist das Atom stationär, es gibt also keine Bewegungen von Elektronen auf Bahnen. Anders als es das Bohr-Modell annimmt, hat das Elektron beim atomaren Wasserstoff eine endliche Aufenthaltswahrscheinlichkeit im Kern. Orbitale können mit zwei Kernen assoziiert sein und so chemische Bindungen vermitteln. |
|||
| ⚫ | |||
| ⚫ | Das Atommodell von Bohr steht in vielen Punkten im Widerspruch zu der durch Messung zugänglichen Realität. Einige dieser Widersprüche waren bereits zur Zeit der Entstehung des Modells bekannt. Andere wurden später mit verbesserten Experimenten und weiter ausgearbeiteter Theorie der [[Quantenmechanik]] offensichtlich: |
||
* Die Bewegung des Elektrons (Beschleunigung auf einer [[gleichmässige Kreisbewegung|Kreisbahn]]) widersprecht der klassischen [[Elektrodynamik]]. |
|||
* Ein Atom, das nur aus einem Proton und einem mit festem Bahndrehimpuls kreisenden Elektron besteht, ist scheibenförmig und nicht wie das Wasserstoffatom im Grundzustand kugelförmig. |
|||
* Atome mit mehreren Elektronen und chemische Bindungen zwischen Atomen können mit dem Bohrschen Modell nicht befriedigend erklärt werden. |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
* Das Bohrsche Atommodell ist ein Relikt aus der Frühzeit der [[Quantenphysik]] und sollte aus den Lehrplänen der Mittel- und Hochschulen gestrichen werden. |
|||
Die [[Quantenmechanik]] zeigt ein grundsätzlich anderes Bild vom Atom: die Elektronen bewegen sich nicht auf irgend welchen Bahnen, sondern befinden sich in bestimmten Zuständen. |
|||
== Ausblick == |
== Ausblick == |
||
Das bohrsche Atommodell fand im [[Bohr-Sommerfeldsches Atommodell]] verschiedene Erweiterungen. So wurde unter anderem eine zweite und dritte Quantenzahl eingefügt, um [[Feinstruktur]]-Aufspaltungen zu erklären. Der [[Stern-Gerlach-Versuch]] erweiterte das Modell abermals um den [[Spin]]. |
Das bohrsche Atommodell fand im [[Bohr-Sommerfeldsches Atommodell]] verschiedene Erweiterungen. So wurde unter anderem eine zweite und dritte Quantenzahl eingefügt, um [[Feinstruktur]]-Aufspaltungen zu erklären. Der [[Stern-Gerlach-Versuch]] erweiterte das Modell abermals um den [[Spin]]. Mit der [[Quantenmechanik]] ist eine umfassendere Theorie entstanden, die auch die Bohrschen Postulate vollständig begründet. Die Bohrsche Auswahlbedingung kann durch zwei grundlegende quantenmechanische Prinzipien - den [[Materiewellen]] bzw. die [[Unschärferelation|Heisenbergsche Unschärferelation]] - plausibel erklärt werden |
||
Mit der [[Quantenmechanik]] wurden beide Modelle abgelöst, zugleich aber auch die bohrschen Postulate vollständig begründet. Es wurde erkennbar, warum das bohrsche Modell und seine Erweiterung in vielen Bereichen Erfolge hatten, das heißt richtige Voraussagen trafen. |
|||
An dieser Stelle sollen zwei Beispiele gegeben werden, wie die bohrsche Auswahlbedingung schon durch grundlegende quantenmechanische Prinzipien - den [[Materiewellen]] beziehungsweise die [[heisenbergsche Unschärferelation]] - plausibel gemacht werden kann, ohne in irgendeiner Form den quantenmechanischen Formalismus aufzubauen. |
|||
=== De Broglie === |
=== De Broglie === |
||
[[Bild:BohrschesAtommodellMateriewellen.jpg|thumb|Materiewelle des Eletrons]]Schon 1923 betrachtete ''Louis-Victor de Broglie'' Elektronen zum ersten Mal als Wellen ([[Materiewellen]]) und zeigte mithilfe einer [[Spezielle Relativitätstheorie|relativistischen]] Argumentation, dass ein Elektron mit dem [[Impuls]] die folgende Wellenlänge (''λ'') besitzt |
|||
:<math>\lambda = { h \over p } |
:<math>\lambda = { h \over p }</math> |
||
Modelliert man das umlaufende Elektrons als stehende Welle, muss der Umfang so gewählt werden, dass ein ganzzahliges Vielfaches der Länge der zugehörigen Materiewelle auf die Kreisbahn passt: |
|||
:<math>2 |
:<math>2\pi r=n\lambda \Leftrightarrow 2 \pi r=n{h\over p} \Leftrightarrow pr =n\hbar \Leftrightarrow L=n \hbar;</math> |
||
Damit folgt die Bohrsche Auswahlbedingung aus der Forderung, dass die Elektronen im Atom stehende Wellen ausbilden. |
|||
genau Bohrs Auswahlbedingung. |
|||
=== Heisenberg === |
=== Heisenberg === |
||
Eine häufig gebrauchte Formulierung der [[ |
Eine häufig gebrauchte Formulierung der [[Unschärferelation|heisenbergschen Unschärferelation]] besagt, dass für die Ortsunschärfe <math>\Delta x</math> und die Impulsunschärfe <math>\Delta p</math> stets gilt |
||
:<math> \Delta x \Delta p \ge h </math>. |
:<math> \Delta x \Delta p \ge h </math>. |
||
Gleichartige Relationen gelten aber auch unter anderem für Energie und Zeit |
Gleichartige Relationen gelten aber auch unter anderem für Energie und Zeit und für [[Drehimpuls]] L und Drehwinkel <math>\varphi</math>: |
||
:<math> \Delta L \Delta \varphi \ge h </math>. |
:<math> \Delta L \Delta \varphi \ge h </math>. |
||
Nun kann man bei der Messung eines Drehwinkels |
Nun kann man bei der Messung eines Drehwinkels maximal einen Fehler von <math>2\pi</math> (360°) machen |
||
:<math> |
:<math>\Delta \varphi_{max} = 2\pi</math> |
||
Folglich gilt für die Unschärfe des Drehimpulses |
|||
:<math>\Delta L\Delta \varphi_{max} \ge h\Rightarrow \Delta L \ge \frac{h}{2\pi} = \hbar </math>. |
|||
Für minimale Unschärfe von L gilt dann: |
Für minimale Unschärfe von L gilt dann: |
||
| Zeile 133: | Zeile 127: | ||
:<math> \Delta L_{min} = \hbar </math> |
:<math> \Delta L_{min} = \hbar </math> |
||
Man kann also sagen, dass der Drehimpuls einen Bereich von <math>\hbar</math> für sich beansprucht. Drehimpulse müssen also, um unterscheidbar zu sein, mindestens diesen Abstand oder ein Vielfaches davon haben. |
Man kann also sagen, dass der Drehimpuls infolge der Unschärferelation einen Bereich von <math>\hbar</math> für sich beansprucht. Drehimpulse müssen also, um unterscheidbar zu sein, mindestens diesen Abstand oder ein Vielfaches davon haben. Folglich gilt |
||
:<math> L = n \hbar.</math> |
:<math> L = n \hbar.</math> |
||
Dies ist genau die Auswahlbedingung von Bohr. |
Dies ist genau die Auswahlbedingung von Bohr. |
||
===Links=== |
|||
*'''[http://www.youtube.com/watch?v=elysoslqbDA Video auf Youtube]''' |
|||
[[Kategorie:Quant]] |
[[Kategorie:Quant]] |
||
Aktuelle Version vom 24. Januar 2013, 15:27 Uhr
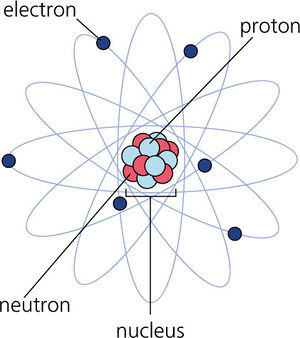
Das Bohrsche Atommodell wurde 1913 von Niels Bohr entwickelt und baut auf dem Rutherfordsches Atommodell (Elektronen umkreisen einen serh kleinen, positiv geladenen Atomkern) auf. Das Bohrsche Atommodell konnte wohl die Spektrallinien des Wasserstoffatoms erklären, erwies sich sonst aber als Sackgasse. Dass dieses Modell heute noch an Schulen gelehrt wird, ist ein deutliches Indiz für den Reformbedarf des Physikunterrichts.
Modell
Im Bohrschen Atommodell umkreist ein Elektron auf Kreisbahnen den Kern (Proton, Heliumkern). Da gemäss den Gesetzen der Elektrodynamik eine beschleunigte Ladung elektromagnetische Strahlung aussendet, müsste das Elektron in kürzester Zeit auf den Kern abstürzen. Bohr postulierte deshalb, dass das Elektron auf den zugelassenen (stabilen) Bahnen nicht strahlt und nur beim Übergang von einer Bahn auf die andere ein Lichtteilchen (Photon) aussenden oder absorbiert.
Bohrsche Postulate
Bohr formulierte sein Modell, indem er das Rutherfordsches Atommodell um drei Postulate erweiterte:
- Elektronen bewegen sich auf stabilen Kreisbahnen um den Atomkern ohne elektromagnetische Strahlung zu emittieren.
- Der Radius der Elektronenbahn ändert sich nicht kontinuierlich, sondern sprunghaft. Bei diesem Quantensprung wird ein Photon abgegeben oder aufgenommen.
- Elektronenbahnen sind stabil, falls der Bahndrehimpuls des Elektrons ein ganzzahliges Vielfaches des Planckschen Wirkungsquantums [math]\hbar[/math] ist. Dieses Postulat wird häufig auch Auswahlbedingung genannt.
Bahnradius
Im Bohrschen Atommodell wird das Elektron (Masse m, Ladung -e) durch die elektrostatische Kraft des Atomkerns auf einer Kreisbahn gehalten (1. Postulat)
- [math] F_E=\frac{1}{4\pi\varepsilon_0}\frac{e^2}{r^2}=ma_n={mv^2\over r }[/math]
Der Bahndrehimpuls des Elektrons L ist nach dem 3. Postulat quantisiert
- [math]L=mvr=n\hbar \Leftrightarrow\ v={n\hbar\over mr}[/math].
Setzt man die so gewonnene Beziehung zwischen Geschwindigkeit und Radius ins Grundgesetz der Mechanik (Impulsbilanz) ein, erhält man für den Radius r:
- [math]{1 \over 4\pi\varepsilon_0}{e^2 \over r^2 }={m({n\hbar\over mr})^2\over r} \Leftrightarrow {e^2 \over 4 \pi \varepsilon_0 r^2}={m n^2 \hbar^2 \over m^2r^3 } \Leftrightarrow[/math]
- [math] r=n^2{4 \pi\varepsilon_0\hbar^2\over m e^2 }[/math].
Der kleinste Radius wird als Bohrscher Atomradius bezeichnet
- [math] r_0 = { 4 \pi \varepsilon_0 \hbar^2 \over m e^2 } \approx 5.29 \cdot 10^{-11}m[/math].
Energie
Die potentielle Energie des Elektrons im Feld des Protons ist gleich
- [math]W_E=-{1\over 4\pi\varepsilon_0}{e^2\over r}[/math]
Für die kinetische Energie gilt
- [math]W_{kin} = {1\over 2}mv^2 ={1\over 8\pi\varepsilon_0}{ e^2\over r}= -{1 \over 2}W_E[/math],
Demnach ist die Gesamtenergie des Elektrons im Feld des Protons gleich
- [math]W=W_{kin}+W_E={1\over 2}W_{pot}=-{1\over 8\pi\varepsilon_0}{ e^2\over r}[/math].
Setzt man nun die durch die Quantisierung des Bahndrehimpulses erlaubten Radien ein, erhält man die möglichen Energieniveaus
- [math]W={1\over 2}W_{pot}=-{1\over 8\pi\varepsilon_0}{e^2\over {n^2{4 \pi\varepsilon_0\hbar^2\over m e^2 }}}=-{m e^4\over 32\pi^2\varepsilon_0^2\hbar^2}{ 1\over n^2}[/math].
Die Energiedifferenz beim Übergang vom [math]n_1[/math]-ten in den [math]n_2[/math]-ten Zustand ist damit gleich
- [math]\Delta W = W_{n_2}-W_{n_1}={m e^4\over 32\pi^2 \varepsilon_0^2 \hbar^2}\left( {1 \over n_1^2 }-{1 \over n_2^2}\right)={m e^4\over 8 \varepsilon_0^2 h^2}\left( {1 \over n_1^2 }-{1 \over n_2^2}\right)[/math]
Bei der letzten Umformung ist das Drehimpulsquantum [math]\hbar[/math] durch das um 2π grössere Wirkungsquantum h ersetzt worden. Diese Formel wurde bereits 1888 von Johannes Rydberg ohne Kenntnis eines Atommodells allein aufgrund von beobachteten Linienspektren aufgestellt.
Für das vom Elektron beim Übergang absorbierte oder emittierte Photon gilt der von Albert Einstein postulierte Zusammenhang zwischen Energie und Frequenz f
- [math]W=hf[/math].
Springt das Elektron vom [math]n_1[/math]-ten in den [math]n_2[/math]-ten Zustand, ist die Frequenz des emittierten oder absorbierten Photons gleich
- [math]f= {{m e^4}\over {8\epsilon_0^2 h^3} }\left({1\over n_2^2}-{1\over n_1^2}\right)[/math].
Lässt man [math]n_1[/math] gegen Unendlich gehen, erhält man die Energie, die nötig ist, um ein Elektron aus dem Unendlichen bis zum Zustand [math]n_2[/math] zu bewegen, also die Gesamtenergie des Zustands [math]n_2[/math].
Exaktere Werte erhält man, wenn man berücksichtigt, dass sich sowohl das 1836 Mal schwerere Protons als auch das Elektrons um den gemeinsamen Massenmittelpunkt bewegen. Um den Einfluss des sich bewegenden Protons zu korrigieren, sind die Energie- und Frequenzwerte mit folgendem Faktor zu korrigieren
- [math] { 1 \over 1 + { m_{\mathrm{Elektron}} \over m_{\mathrm{Kern}} } } \approx { 1 \over 1{,}00055 } [/math].
Bestätigungen
Das bohrsche Atommodell konnte eine Reihe von physikalischen Messergebnissen der im Entstehen begriffenen Atomphysik erklären. In nachfolgenden mit höherer Genauigkeit durchgeführten Experimenten zeigten sich allerdings auch deutliche Abweichungen zwischen Modell und Wirklichkeit.
Grösse der Atome
Der mit den wenigen Grundannahmen des Modells berechnete Durchmesser von Atomen liegt für viele Elemente in der richtigen Grössenordnung. Insbesondere stimmten sie grob mit den zur gleichen Zeit von Max von Laue und William Henry Bragg erstmals durchgeführten Experimenten zur Röntgenbeugung überein. Die kleine, aber endliche Grösse war eine Schlüssel-Eigenschaft der Atome in den noch vagen Vorstellungen zum Aufbau der Materie. Daher wurde die Fähigkeit des Bohr-Modells, die Grösse aus allgemeinen Annahmen abzuleiten, als Erfolg angesehen.
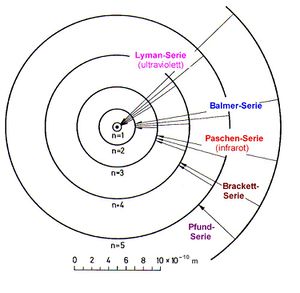
Spektrale Übergänge
Schon 1885 wurden spektrale Linien beim Wasserstoff-Atom entdeckt (Balmer-Serie, später Lyman-Serie, Paschen-Serie und weitere). Für die Position der Linien innerhalb der jeweiligen Serie konnte Johannes Rydberg anhand von gemessenen Linienspektren bereits 1888 eine numerische Formel angeben. Der physikalische Hintergrund dieser Formel blieb jedoch zwanzig Jahre lang ein Rätsel. Die von Bohr eingeführten spektralen Übergänge der Elektronen von einer Schale auf die andere erlaubten, die Rydberg-Formel aus allgemeinen Prinzipien abzuleiten.
Franck-Hertz-Versuch
Eine weitere Bestätigung des Bohrschen Atommodells erfolgte 1913/1914 mit dem Franck-Hertz-Versuch. In dem Versuch konnte gezeigt werden, dass die Abgabe von Energie nur in bestimmten, diskreten Paketen möglich ist. Damit war der Quantenaspekt des Bohrschen Atommodells bestätigt.
Mängel
Das Atommodell von Bohr steht in vielen Punkten im Widerspruch zu der durch Messung zugänglichen Realität. Einige dieser Widersprüche waren bereits zur Zeit der Entstehung des Modells bekannt. Andere wurden später mit verbesserten Experimenten und weiter ausgearbeiteter Theorie der Quantenmechanik offensichtlich:
- Die Bewegung des Elektrons (Beschleunigung auf einer Kreisbahn) widersprecht der klassischen Elektrodynamik.
- Ein Atom, das nur aus einem Proton und einem mit festem Bahndrehimpuls kreisenden Elektron besteht, ist scheibenförmig und nicht wie das Wasserstoffatom im Grundzustand kugelförmig.
- Atome mit mehreren Elektronen und chemische Bindungen zwischen Atomen können mit dem Bohrschen Modell nicht befriedigend erklärt werden.
- Der Bahndrehimpuls des Elektrons müsste nach dem Bohrschen Modell im Grundzustand gleich [math]\hbar[/math] sein, tatsächlich ist er aber gleich Null.
- Die Aufspaltung der Spektrallinien unter dem Einfluss von Magnetfeldern (Zeeman-Effekt) kann mit dem Bohrschen Atommodell nicht erklärt werden.
- Durch die geringen Abmessungen des Atoms verletzt die Vorstellung einer definierten Bahn des Elektrons um den Atomkern die 1927 entdeckte Heisenbergsche Unschärferelation.
- Das Bohrsche Atommodell ist ein Relikt aus der Frühzeit der Quantenphysik und sollte aus den Lehrplänen der Mittel- und Hochschulen gestrichen werden.
Die Quantenmechanik zeigt ein grundsätzlich anderes Bild vom Atom: die Elektronen bewegen sich nicht auf irgend welchen Bahnen, sondern befinden sich in bestimmten Zuständen.
Ausblick
Das bohrsche Atommodell fand im Bohr-Sommerfeldsches Atommodell verschiedene Erweiterungen. So wurde unter anderem eine zweite und dritte Quantenzahl eingefügt, um Feinstruktur-Aufspaltungen zu erklären. Der Stern-Gerlach-Versuch erweiterte das Modell abermals um den Spin. Mit der Quantenmechanik ist eine umfassendere Theorie entstanden, die auch die Bohrschen Postulate vollständig begründet. Die Bohrsche Auswahlbedingung kann durch zwei grundlegende quantenmechanische Prinzipien - den Materiewellen bzw. die Heisenbergsche Unschärferelation - plausibel erklärt werden
De Broglie
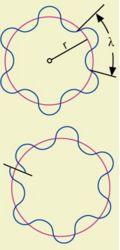
Schon 1923 betrachtete Louis-Victor de Broglie Elektronen zum ersten Mal als Wellen (Materiewellen) und zeigte mithilfe einer relativistischen Argumentation, dass ein Elektron mit dem Impuls die folgende Wellenlänge (λ) besitzt
- [math]\lambda = { h \over p }[/math]
Modelliert man das umlaufende Elektrons als stehende Welle, muss der Umfang so gewählt werden, dass ein ganzzahliges Vielfaches der Länge der zugehörigen Materiewelle auf die Kreisbahn passt:
- [math]2\pi r=n\lambda \Leftrightarrow 2 \pi r=n{h\over p} \Leftrightarrow pr =n\hbar \Leftrightarrow L=n \hbar;[/math]
Damit folgt die Bohrsche Auswahlbedingung aus der Forderung, dass die Elektronen im Atom stehende Wellen ausbilden.
Heisenberg
Eine häufig gebrauchte Formulierung der heisenbergschen Unschärferelation besagt, dass für die Ortsunschärfe [math]\Delta x[/math] und die Impulsunschärfe [math]\Delta p[/math] stets gilt
- [math] \Delta x \Delta p \ge h [/math].
Gleichartige Relationen gelten aber auch unter anderem für Energie und Zeit und für Drehimpuls L und Drehwinkel [math]\varphi[/math]:
- [math] \Delta L \Delta \varphi \ge h [/math].
Nun kann man bei der Messung eines Drehwinkels maximal einen Fehler von [math]2\pi[/math] (360°) machen
- [math]\Delta \varphi_{max} = 2\pi[/math]
Folglich gilt für die Unschärfe des Drehimpulses
- [math]\Delta L\Delta \varphi_{max} \ge h\Rightarrow \Delta L \ge \frac{h}{2\pi} = \hbar [/math].
Für minimale Unschärfe von L gilt dann:
- [math] \Delta L_{min} = \hbar [/math]
Man kann also sagen, dass der Drehimpuls infolge der Unschärferelation einen Bereich von [math]\hbar[/math] für sich beansprucht. Drehimpulse müssen also, um unterscheidbar zu sein, mindestens diesen Abstand oder ein Vielfaches davon haben. Folglich gilt
- [math] L = n \hbar.[/math]
Dies ist genau die Auswahlbedingung von Bohr.